Primärbindungen – Definition
Grundsätzlich können Atome also auf drei Arten miteinander verbunden sein, nämlich über
- Ionenbindungen
- Atombindungen
- Metallbindungen
Es sei hier angemerkt, dass diese drei Bindungsarten bzw. die Primärbindungen zu den sogenannten starken Wechselwirkungen gezählt werden (weil sie stärker sind als die schwachen Wechselwirkungen). Es gibt auch Bindungsarten, welche zu den schwachen Wechselwirkungen gezählt werden, nämlich die Sekundärbindungen, die in einem anderen Artikel behandelt werden.
Um die Primärbindungen zu verstehen, musst Du erstens wissen, wie Atome prinzipiell aufgebaut sind und zweitens, was die Elektronegativität ist.
Atome bestehen nach dem Bohrschen Atommodell aus einem Atomkern und einer Atomhülle, die in unterschiedliche Schalen unterteilt sind. Im Atomkern befinden sich die Protonen (positiv geladene Elementarteilchen) und die Neutronen.
In der Atomhülle befinden sich die Elektronen, die an Bindungen beteiligt sind. Elektronen können aus der Atomhülle entfernt und hinzugefügt werden. Ebenso können sie durch Überlappung zweier Atomhüllen (von zwei Atomen) miteinander geteilt werden. Dabei ist nur die äußerste Schale (Außenschale) eines Atoms mit ihren Elektronen an Reaktionen beteiligt.
Das Verständnis, dass die Atomhülle, also der ,,Ort" im Atom ist, wo sich die Elektronen befinden und der Elektronen beinhaltet, die entfernbar/,,hinzufügbar" sind, ist wichtig, um alle Primärbindungen zu verstehen.
Die Elektronegativität ist eine positive Zahl, die maximal gleich 4 ist. Jedes Atom hat eine charakteristische Elektronegativität, die sich nicht verändert. Die Elektronegativität gibt an, wie stark ein Atom an Elektronen zieht und diese ,,Zugstärke" ist größer, je höher die Elektronegativität ist. Um den ,,Stärkeunterschied" zweier Atome zu berechnen, zieht man die Elektronegativitäten voneinander ab; das ergibt die Elektronegativitätsdifferenz. Man betrachtet nur den Betrag. Je höher die Elektronegativitätsdifferenz, desto stärker zieht das eine Atom im Vergleich zum anderen Atom. Ist sie gleich 0, ziehen beide Atome gleich stark.
Die Elektronegativität ist ein wichtiges Konzept, um zu verstehen, wann Ionenbindungen und wann Atombindungen entstehen. Damit ist die Elektronegativität also wichtig für Vorhersagen hinsichtlich der Bindungsentstehung.
Außerdem braucht man die Elektronegativität, um zwischen verschiedenen Atombindungen zu unterscheiden, die im Folgenden noch besprochen werden. Sie ist also auch wichtig, um Bindungen zu charakterisieren.
Primärbindungen – Ionenbindungen
Wie werden Atome über Ionenbindungen zusammengehalten?
Bei den Ionenbindungen ziehen sich Kation (positiv geladenes Ion) und Anion (negativ geladenes Ion) elektrostatisch an.
Dass sich gegensätzliche Ladungen anziehen, kennst Du sicherlich schon aus der Physik.
Doch wie entstehen Kationen und Anionen?
Atome liegen erst einmal als Elemente vor, die genauso viele Elektronen haben, wie sie Protonen im Atomkern haben. Die Elemente sind damit neutral (keine Ladung).
Aus Gründen der Energiearmut (, die angestrebt wird) nehmen Elemente Elektronen auf oder geben Elektronen ab, bis sie auf ihrer Außenschale genauso viele Elektronen haben wie ein Edelgas.
Edelgase sind die Elemente der achten Hauptgruppe im Periodensystem und sie sind sehr reaktionsträge.
Wegen diesem ,,Streben" nach Energiearmut geben Elemente Elektronen ab oder nehmen welche auf, je nachdem, was weniger Energie benötigt bzw. bei welchem Vorgehen weniger Elektronen bewegt werden müssen.
Atome ,,streben" einen reaktionsträgen Zustand an. Dazu nehmen sie Elektronen auf oder geben welche ab, um genauso viele Elektronen wie ein Edelgas zu haben. Denn die Elektronenkonfiguration (bzw. Elektronenanzahl/-verteilung) von Edelgasen ist energetisch günstig, was bedeutet, dass das Atom dadurch energiearm/reaktionsträge ist.
Dabei passt es natürlich, wenn zwei Elemente aufeinandertreffen, von denen eines eher Elektronen abgeben und das andere eher Elektronen aufnehmen würde.
Das Element, das seine Elektronen abgibt, ist dann positiv geladen (Kation/Elektronenmangel).
Das Element, das Elektronen eher aufnimmt, ist negativ geladen (Anion/Elektronenüberschuss).
Nach Elektronenübertragung liegen Kation und Anion vor, die sich dann gegenseitig elektrostatisch anziehen und damit über eine ionische Bindung zusammengehalten werden.
Man nennt fast alle ionischen Bindungen auch Salze.
Kationen und Anionen ordnen sich bei Salzen in einem regelmäßigen Kristallgitter an.
Betrachtet werden die Elemente Natrium (Na) und Chlor (Cl).
Natrium hat ein Außenelektron und wird von daher ,,bestrebt sein" dieses Elektron abzugeben (hat dann die Elektronenkonfiguration von Neon).
Chlor hingegen hat sieben Außenelektronen und wird ,,bestrebt sein" genau ein Elektron aufzunehmen (hat dann die Elektronenkonfiguration von Argon).
Natrium und Chlor reagieren also folgendermaßen miteinander:
Das Natriumatom hat ein Elektron an das Chloratom abgegeben.
Dadurch ist Natrium jetzt einfach positiv und Chlor einfach negativ geladen.
Wenn die Ionen nicht in Wasser gelöst sind, verbinden sie sich über elektrostatische Anziehung und bilden ein Kristallgitter aus, in welchem sich Natriumkationen und Chloridanionen abwechseln.
 Bildbeschreibung
Bildbeschreibung
Primärbindungen – Atombindungen
Atombindungen werden auch kovalente Bindungen genannt.
Kovalent deswegen, weil sich Atome Elektronen teilen, um eine volle Außenschale zu haben
(ko-valent; ,,ko-" wie im Sinne einer Kooperation und ,,valent" im Sinne von ,,Wertigkeit", was sich auf die Elektronen bezieht).
Damit ergibt sich ein Unterschied zur Ionenbindung, nämlich, dass Elektronen hier nicht übertragen werden, sondern geteilt werden und somit in den Atomhüllen beider Atome sind.
Das heißt, dass die Elektronen durch Überlappung zweier Atomhüllen geteilt werden.
Dadurch ,,haften" sie aneinander.
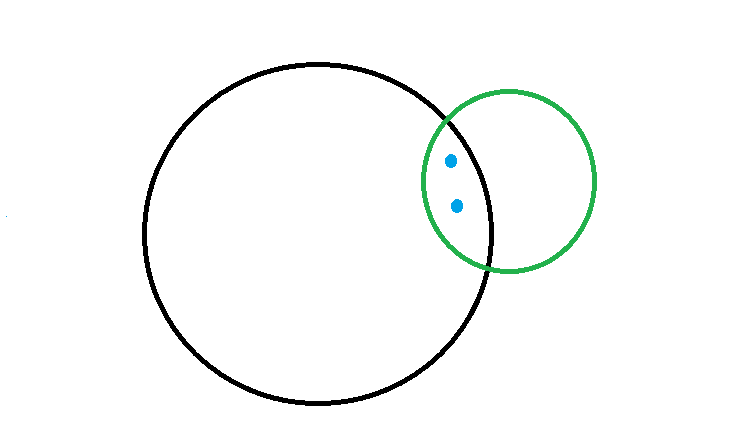
Abbildung 2: schemenhafte Darstellung, wie sich zwei Atome (schwarz und grün) durch Überlappung ihrer Elektronenhüllen zwei Elektronen (in blau) teilen Quelle: StudySmarter
Der Grund, warum Elektronen nicht wie bei den Ionenbindungen einfach übertragen werden,
liegt in der Elektronegativität begründet.
Sie ist ein Maß dafür, wie stark Atome an Elektronen ziehen.
Der grundlegende Unterschied zu den Ionenbindungen ist der, dass bei den kovalenten Bindungen die Elektronen in etwa gleich stark ziehen und deshalb die geteilten Elektronen nicht endgültig vom schwächer ziehenden Atom durch das stärker ziehende Atom entfernt werden.
Bei Ionenbindungen ist es so, dass das eine Atom viel stärker an dem Elektron des anderen Atoms zieht und damit dem schwächer ziehenden Atom das Elektron ,,entreißt", wie bei einem Tauziehwettbewerb.
 Abbildung 3: Bindungen als Tauziehwettbewerb
Abbildung 3: Bindungen als Tauziehwettbewerb
Um zu wissen, wann Atombindungen und wann Ionenbindungen ausgebildet werden, zieht man die Elektronegativitäten der beiden Atome(, die man am Periodensystem für jedes Element ablesen kann) voneinander ab.
Dann betrachtet man bloß den Betrag (Vorzeichen ignorieren!).
Wenn die so berechnete Elektronegativitätsdifferenz (Δ EN, sprich ,,Delta E N") größer als 1.7 ist, ist der ,,Stärkeunterschied" beider Atome zu hoch und es findet eine Elektronenübertragung statt (ionische Bindung).
Wenn sie unter 1.7 liegt, ist der ,,Stärkeunterschied" zu gering, als dass Elektronen von einem Atom entrissen werden und sie werden geteilt (es entsteht eine kovalente Bindung).
Die Grenze von 1.7 ist jedoch eine ungefähre Grenze und kann variieren.
Man unterscheidet jedoch auch kovalente Bindungen untereinander, und zwar unterscheidet man zwischen polaren kovalenten Bindungen und unpolaren kovalenten Bindungen.
Polare kovalente Bindungen
Wenn die Elektronegativitätsdifferenz zwischen 0.5 und 1.7 liegt, ist die kovalente Bindung polar.
,,Polar" ist so zu verstehen, dass sich quasi zwei unterschiedlich geladene Pole ähnlich eines Magneten (Pluspol/Minuspol) bilden. Die Struktur zweier verschieden geladener Pole bezeichnet man auch als Dipol.
Denn wenn die Elektronegativität zwischen 0.5 und 1.7 liegt, zieht ein Atom noch relativ stark an den Elektronen, im Gegensatz zum anderen Atom, auch wenn die ,,Zugstärke" nicht ausreicht, um das Elektron dem schwächer ziehenden Atom komplett zu entreißen und eine ionische Bindung auszubilden.
Dadurch, dass das eine Atom viel stärker zieht, befinden sich die Elektronen näher am stärker ziehenden Atom, aber die Elektronen werden trotzdem geteilt.
Dadurch ist das stärker ziehende Atom partiell negativ geladen (partiell = zum Teil).
Partiell deshalb, weil man erst dann von einer ,,richtigen" negativen Ladung spricht, wenn das Elektron nicht geteilt wird und komplett dem einen Atom ,,gehört".
Das andere, schwächer ziehende Atom ist partiell positiv geladen.
Denn das Elektron wird diesem schon fast entzogen, dadurch, dass es sich näher am stärker ziehenden Atom befindet.
Man kann sich diese partiellen Ladungen wie schwächere Ladungen vorstellen, die aber dennoch eine Auswirkung auf das Teilchenverhalten haben.
Das partiell positiv geladene Atom wird schwach von negativen (oder auch partiell negativen) Ladungen angezogen. Dasselbe gilt auch für das partiell negativ geladene Atom (auch wieder mit gegensätzlicher Ladung).
Betrachtet wird die Bindung HCl (Salzsäure).
Wasserstoff (H) hat eine Elektronegativität von 2.2
Chlor (Cl) hat eine Elektronegativität von 3.16.
Es ergibt sich die Elektronegativitätsdifferenz 3.16 - 2.2 = 0.96
Damit ist die Bindung HCl eine polare kovalente Bindung, denn 0.5 < 0.96 < 1.7
Da Chlor eine höhere Elektronegativität hat und damit stärker zieht, ist Chlor partiell negativ geladen, während Wasserstoff partiell positiv geladen ist.
Um die partiellen Ladungen zu kennzeichnen, schreibt man über die Atome in der Strukturformel entsprechend (sprich: delta plus) beim Wasserstoffatom und beim Chloratom.
Unpolare kovalente Bindung
Wenn die Elektronegativitätsdifferenz kleiner als 0.5 ist (und sie kann minimal 0 sein, da wir das Vorzeichen ignorieren), ist die Bindung unpolar.
Das heißt, dass wir keinen ,,Plus- und Minuspol" haben, wie bei der polaren kovalenten Bindung.
Bei einer Elektronegativitätsdifferenz von kleiner als 0.5 ist der Stärkeunterschied viel zu gering (oder gar nicht vorhanden bei einer Differenz von 0), als dass man sagen kann, dass das eine Atom im Vergleich zum Anderen negativ geladen ist.
Die beiden Atome sind mehr oder weniger neutral und haben entsprechend kein schwaches ionisches Verhalten, wie es bei den Atomen der polaren kovalenten Bindung der Fall ist.
Die Elektronen befinden sich nahezu mittig zwischen den beiden Atomen, anstatt näher zum stärker ziehenden Atom zu sein.
Primärbindungen – Metallbindungen
Bei Metallbindungen ist es so, dass Elemente, die zu den Metallen gezählt werden, ihre Elektronen vom Atom lösen, sodass sich diese um den Atomrumpf gleichmäßig verteilen.
Die Gesamtheit all dieser frei beweglichen Elektronen bezeichnet man als Elektronengas, wobei es kein Gas im eigentlichen Sinne ist.
Mehrere Metallatome können zusammen ihre Elektronen loslösen, sodass Atomrümpfe nebeneinander liegen und von jedem Atomrumpf entsprechend viele Elektronen losgelöst werden, welche die Atomrümpfe umgeben.
 Abbildung 4: Aufbau einer Metallbindung bestehend aus den positiv geladenen Atomrümpfen (rot) und den frei beweglichen Elektronen (blau)
Abbildung 4: Aufbau einer Metallbindung bestehend aus den positiv geladenen Atomrümpfen (rot) und den frei beweglichen Elektronen (blau)
Das funktioniert deshalb bei den Metallen, weil Metalle eine sehr geringe Elektronegativität haben und von daher eine schwache Anziehungskraft auf die Elektronen ausüben.
Die Atomrümpfe, die nebeneinander liegen, würden sich ohne das Elektronengas natürlich abstoßen, weil sie positiv geladen sind.
Durch das Elektronengas werden die Atomrümpfe aber elektrostatisch ,,fixiert" bzw. festgehalten, wenn man so will.
Die Metallatome können vom selben Element sein oder auch von verschiedenen Elementen.
Bei Metallbindungen von verschiedenen Elementen spricht man auch von Legierungen.
Die Leitfähigkeit von Metallen
Dadurch, dass bei Metallbindungen Elektronen frei beweglich um die Atomrümpfe vorliegen, können diese sehr einfach bewegt werden.
Das erklärt auch, warum Metalle so leitfähig sind.
Man kann nämlich die Elektronen eines Metalls durch Anlegen einer Spannung bewegen.
Bewegte Ladungen (in diesem Fall Elektronen) entsprechen dem Strom, den man aus dem Alltag kennt.
Je mehr frei bewegliche Elektronen vorliegen, desto leitfähiger ist das Metall.
Primärbindungen – Wann welche Bindung entsteht
Im Anschluss ist es wichtig zu verstehen, dass man bei allen Elementen zwischen Metallen und Nichtmetallen unterscheidet.
Grundsätzlich kannst Du Dir merken, dass die Elemente der ersten beiden Hauptgruppen (ohne Wasserstoff) Metalle sind.
Alle Elemente der siebten Hauptgruppe hingegen sind Nichtmetalle und einige Elemente der vierten bis sechsten Hauptgruppe auch (Kohlenstoff (C), Stickstoff (N), Sauerstoff (O), Phosphor (P), Schwefel (S) bzw. ,,CNOPS").
Auf welcher Basis man diese genau unterscheidet, erfährst Du im entsprechenden Artikel zu der Thematik. Du kannst Dir aber zumindest merken, dass Metalle grundsätzlich eine sehr niedrige Elektronegativität aufweisen, während Nichtmetalle eine höhere Elektronegativität aufweisen (größer als 2).
Jedoch kann man grundsätzlich sagen, dass folgende Paarung von Metall und Nichtmetall folgende Bindungen ergibt:
Nichtmetall + Nichtmetall → kovalente Bindung
Nichtmetall + Metall → Ionenbindung
Metall + Metall → Metallbindung
| ΔEN < 0,5 | 0,5 < ΔEN < 1,7 | 1.7 < ΔEN |
| Bindung | unpolar kovalent | polar kovalent | ionisch |
| Bedeutung | Elektronen werden geteilt, wobei beide Atome in etwa gleich stark ziehen (keine Dipolbildung) | Elektronen werden geteilt, wobei ein Atom deutlich stärker zieht (Dipolbildung) | Elektronen wurden übertragen und entstandene Ionen ziehen sich an |











